冷冻电镜助力沈华浩/张岩/应颂敏课题组《Nature Chem Biol》合作揭示哮喘治疗新靶点机制
2021-12-24 16:49 发布人:系统管理员
冷冻电镜助力沈华浩/张岩/应颂敏课题组《Nature Chem Biol》合作揭示哮喘治疗新靶点趋化因子受体CCR1的偏向性信号激活机制
2021年12月23日,浙江大学医学院附属第二医院沈华浩/应颂敏团队与浙江大学医学院生物物理学系张岩团队,共同在《Nature Chemical Biology》发表了题为Identification and mechanism of G protein-biased ligands for chemokine receptor CCR1的研究成果。该研究在国际上首次报道了人源全长趋化因子受体CCR1的精细三维空间结构,阐明了该受体的内源性配体识别与偏向性信号激活机制,为今后靶向CCR1受体的药物研发奠定了基础。
哮喘是全球常见的慢性疾病之一,患病率逐年增加。有数据显示,哮喘在各个国家发病率为1-18%。全球已有哮喘患者逾4亿人,我国20岁及以上哮喘患者人数已达4570万。然而现有的治疗策略下,哮喘的临床控制仍不理想。因此,针对哮喘发病机制、病理过程以及新治疗靶标的研究亟待突破。浙江大学医学院附属第二医院呼吸与危重症医学科—浙江省呼吸疾病诊治和研究重点实验室沈华浩/应颂敏团队经过多年科研攻关,明确了趋化因子受体CCR1的激活在哮喘炎症中的关键作用,首次提出CCR1及其配体是哮喘治疗的新靶标。然而,近二十年来,所有针对哮喘治疗的靶向趋化因子受体的小分子药物开发,在临床II期实验中均告失败。因此,从分子层面解析CCR1如何识别内源性配体并激活下游通路机制,对理解趋化因子-趋化因子受体相互作用及靶向该受体的新药研发具有重大意义。
趋化因子受体CCR1属于A类G蛋白偶联受体(GPCR)。GPCR是人体中最大的细胞跨膜信号转导受体和最重要的药物靶标。据统计,近40%的FDA批准药物以GPCR为靶点发挥药效。浙江大学基础医学院张岩教授课题组长期从事GPCR信号转导和结构药理研究,解析了包括5-羟色胺受体(5-HT receptor)、多巴胺受体(D1R, D2R)、γ-氨基丁酸受体(GABAB receptor)等在内的多个重要药物靶标的信号转导机制。本研究中,沈华浩/应颂敏团队和张岩团队通力合作,成功解析了CCR1及其G蛋白复合物的高分辨率冷冻电镜结构。结合基于结构的功能研究和计算机模拟结果,本研究还首次阐述了Tyr7.43在GPCR的配体识别和信号转导中的关键作用。
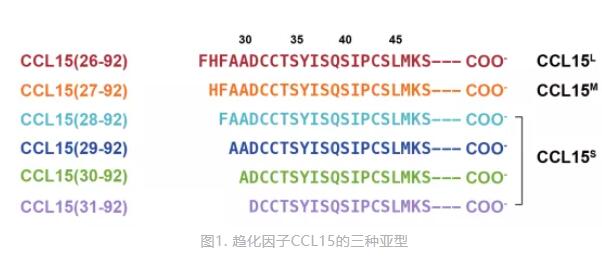
炎症状态下,人体内金属酶的分泌增加,会切割趋化因子CCL15的N端氨基酸,形成多种N端长度不同的CCL15。在该研究中,科研人员发现:N端长度不同的CCL15可以激活受体CCR1产生不同的下游信号。根据下游信号和N端长度的不同,他们CCL15因子分为三类——CCL15L、CCL15M和CCL15S(图1)。这三类CCL15激活CCR1后产生相似的G蛋白信号,但CCL15S激活β-arrestin信号通路的能力显著弱于CCL15L和CCL15M,即发生了偏向性信号转导。
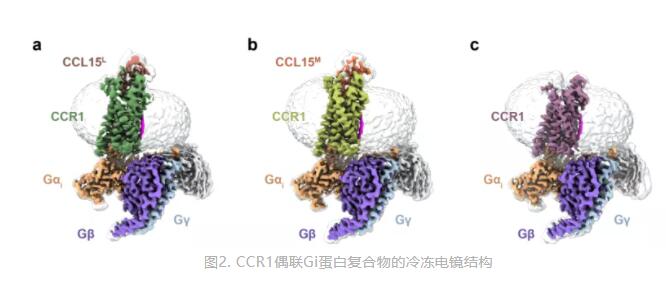
为了探究该现象发生的机制,研究团队采用单颗粒冷冻电镜技术,首次解析了三个高分辨率的趋化因子受体CCR1与Gi蛋白的复合物结构(2.6~2.8埃):分别是结合CCL15L、CCL15M和未结合配体的CCR1受体信号转导复合物结构(图2)。
分子动力学模拟结果同样证明,受体结合口袋内的氨基酸构象与受体的胞内区动力学特征存在关联。具体来说,参与识别下游效应蛋白的TM1、TM7 和H8的胞内区构象在不同配体形式下游明显差异,影响了CCR1对β-arrestin的招募和信号激活。

有趣的是,研究者对所有人类GPCR进行序列比对,发现Tyr7.43在90余种A类GPCR中高度保守,如阿片类受体(μOR, κOR)、血管紧张素受体(AT1R)等。偏向性信号转导机制的研究对于靶向GPCR的药物发现有着重要意义:G蛋白和β-arrestin信号通路通常具有不同的生理功能和药理学应用,特异性激活或抑制某一条信号通路可以有效避免药物副反应,获得高活性低副作用的理想化合物。例如阿片类受体μOR的G蛋白偏向性激动剂TRV130,被证明具有与吗啡相似的止痛功效以更低的副作用,已获得FDA批准上市。因此,该研究系统探索了Tyr7.43位点在受体响应外部信号激活中的作用,为未来靶向GPCR的偏向性药物发现指明了道路。
 zju.edu.cn
zju.edu.cn