冷冻电镜中心助力张海涛课题组揭示药物靶标缓激肽受体的结构信息及激活机制
2022-02-08 15:28 发布人:CCEM2022年2月7日,浙江大学药学院/医学院附属第二医院张海涛研究员团队在国际知名期刊《Nature Communications》上发表了题为“Cryo-EM structures of human bradykinin receptor-Gq proteins complexes”的研究论文,该研究利用冷冻电子显微镜技术,解析了人源缓激肽受体B2R与两种天然肽类配体及Gq蛋白的复合物结构,结合功能试验结果,系统阐明了B2R的配体结合、受体激活及Gq蛋白偶联的分子机制,从而为基于结构的B2R靶向药物研发提供了关键信息。
2型缓激肽受体(type 2 bradykinin receptor,B2R)属于G蛋白偶联受体(GPCR),是激肽释放酶—激肽系统(KKS)的重要组成部分。其通过结合体内的激肽类物质而调控多种生理功能,如疼痛、炎症、血管舒张、血液循环等。在病理情况下,受体功能紊乱会引起遗传性血管水肿,需用B2R靶向药物艾替班特进行治疗。然而,近十几年来,靶向B2R的药物开发均在临床试验中失败,亟需B2R受体的分子结构来助力新型药物的研发工作。
Bradykinin及kallidin均是人体内的激肽物质,由激肽原裂解产生。研究团队利用单颗粒冷冻电镜技术,解析了B2R-Gq-bradykinin及B2R-Gq-kallidin蛋白复合物的高分辨率结构(分辨率分别为3.0Å和2.9Å)。该研究发现肽类配体主要通过配体分子内的氢键及与B2R的Arg196及Ile213形成氢键而在结合口袋中呈现S型的结合构象。配体C末端的Phe与B2R中保守的toggle switch (Trp283)相互作用促使跨膜螺旋TM6的胞内部分及PIF motif中的Phe279外移,导致稳定B2R处于非激活态的DRY和NPxxY motifs的构象发生变化,进而在胞内侧打开了Gq蛋白结合口袋。Gq蛋白的偶联主要通过其C末端的α5螺旋实现,该螺旋与B2R形成了大量的极性及疏水相互作用。有趣的是,B2R的第三个胞内环ICL3和第八个螺旋helix 8均参与了Gq蛋白的偶联,对Gq蛋白的招募及G蛋白的亚型选择性起着重要作用。以上成果不仅从分子水平上系统阐释了配体结合——B2R激活——Gq蛋白偶联的完整机制,而且发现了配体结合的关键位点,为基于B2R结构的药物设计及相关疾病的治疗提供了新的思路。
本文第一作者为浙江大学药学院博士研究生沈金康,通讯作者为浙江大学药学院张海涛研究员。浙江大学冷冻电镜中心为本研究的样品制备和数据收集提供了支持。本课题受到国家重点研发计划、国家自然科学基金和国家科技重大专项等项目的支持。
原文链接:
www.nature.com/articles/s41467-022-28399-1

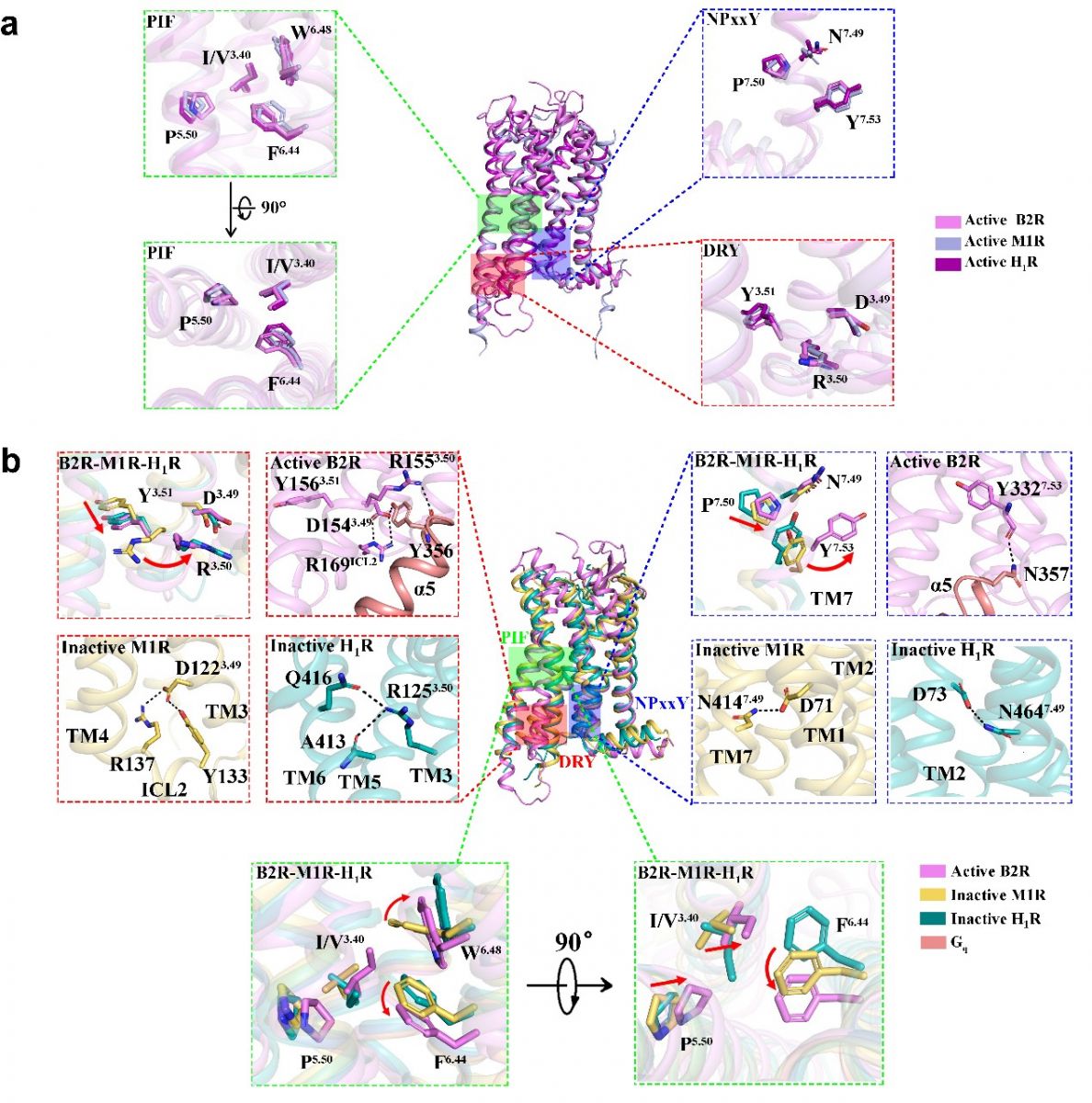
缓激肽受体B2R的激活机制
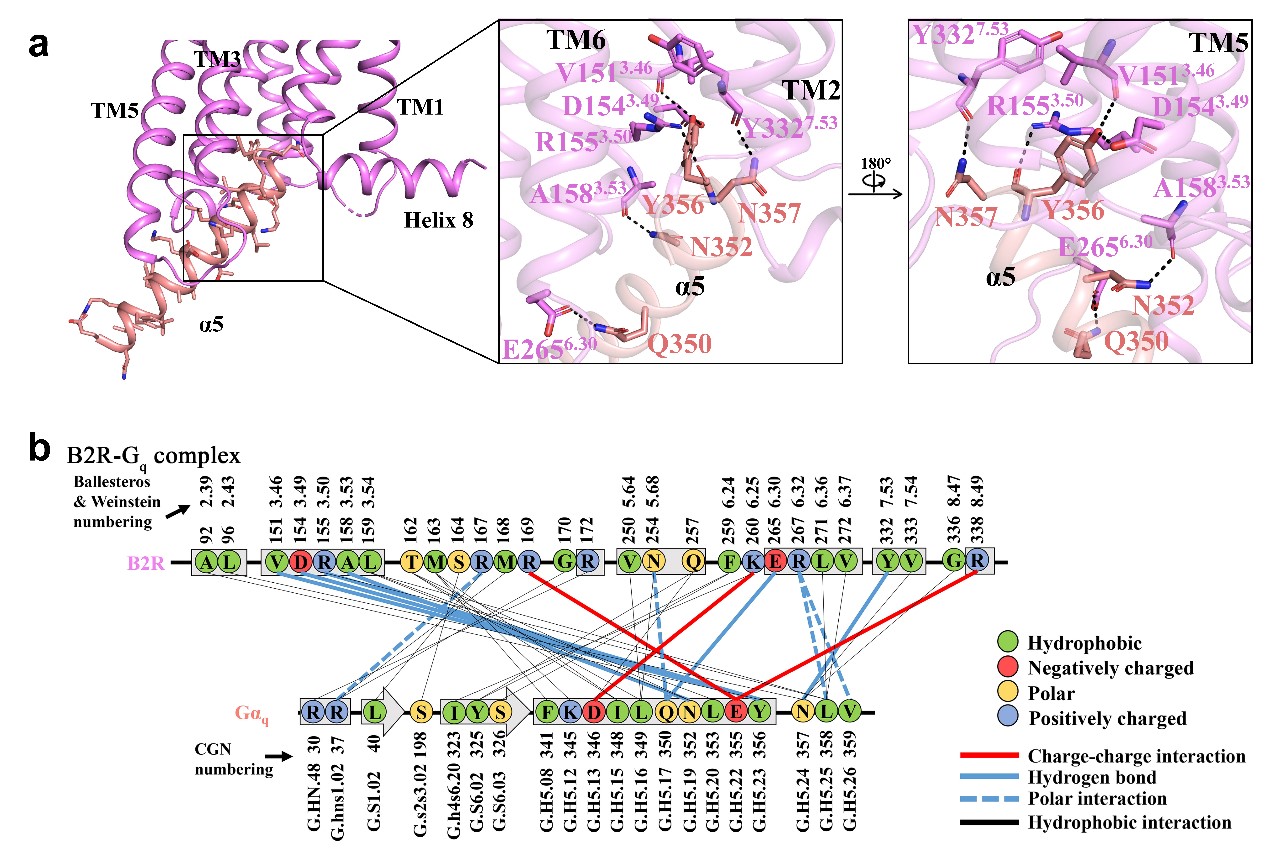
Gq蛋白与缓激肽受体B2R的结合方式
 zju.edu.cn
zju.edu.cn